درک معمای کرونای چینی از دیدگاه داروین
ایرج سبحانی
استاد علوم پزشکی و زیست شناسی دانشگاههای پاریس
.(JavaScript must be enabled to view this email address)
عنوان اصلی نوشته:
درک معمای کرونای چینی از دیدگاه داروین، شواهدی بر رد تئوری جنگ بیولوژی
داروین(۱۸۰۹-۱۷۴۴)[۱]، زیستشناس و زمینشناس انگلیسی، مدتی را در امریکای جنوبی بهسر برد و توانست از طریق مقایسه گونهای (فنوتیپی)[۲]، نقش زمان (تحول) را در راز بقا بیشتر درک کند. از دستاوردهای این اقامت ارائه نظریهای مبتنی بر پیوستگی جغرافیایی گونهها بود که تائیدی بود بر نظریهای که او پیشتر درباره تغییرات نامحسوس ولی جهانی محیط زیست و اقلیم برپایه “همدیسگرایی” داده بود. براساس نظریه داروین موجودات زنده همه شاخههای یکدیگرند و از یک منشاء فرود میآیند. یک محیط درحال تغییر، نیازهای موجودات زنده را تغییر میدهد و هر موجود با تغییر رفتار و استفاده از امکانات خاص برای بقای خویش با محیط سازگار میشود. در واقع بر اساس نظریه داروین موجودات با انتخاب طبیعی تکامل مییابند. در این نگرش، با توجه به تفاوت ذاتی موجودات، طبیعت وسیله تسهیلکننده زیست را برای آن دسته از موجوداتی فراهم میسازد که از مزیتی برای تعامل بهرهمند باشند. گونههایی که منقرض شدهاند (که البته تعدادشان بسیار اندک است) یا به این تعامل نرسیدهاند و یا ناتوان از انتقال حافظه جمعی از نسلی به نسل بعدی بودهاند.
آن دسته از موجوداتی که با وجود تغییرات اقلیمی دوام آورده اند، تعامل مناسبتری با طبیعت داشتهاند. انتخاب برتر طبیعت غریزه پلاستیک را در موجود زنده نهادینه کرده است. هر موجود زنده برای بقا، همانند پلاستیک، خود را با همنوعان و محیط بیرونی (طبیعت و سایر موجودات) وفق داده و به تعامل میرسد.
داروین این شناخت را از گونهنگاری شروع کرد. تا دهه ۱۹۶۰، مقایسه بین گونهها، رفتارها و توزیع جغرافیایی آنها تنها وسیله موجود برای ساخت طبقهبندی گونهها بود. یک قرن بعد ثابت شد که حاصل این تعاملات “کدها” یا “قرار دادهایی” فردی و اجتماعی هستند که از نسلی به نسل دیگر منتقل میشوند.
بدین ترتیب، پیروان داروین زیر بنای گونه را عنصر یا “ژن” خوانده و ساختار زیستشناسی آن را “دیانای”[۳] نام نهادند. میتوان دیانای را حاوی تمام کدهای ذرهبینی تباری دانست. یعنی هر اطلاعی که از ابتدای خلقت موجود زنده برای تعامل با محیط لازم است از نسلی به نسل بعدی رسیده تا هم یاریگر حیات بالفعل موجود زنده باشد و هم در صورت لزوم برای مقابله با وضعیت و شرایط جدید (همچون تغییرات اقلیمی) بتوان از آن درس گرفت. از این منظر “دیانای” را میتوان معادل “دادههای نیاکانی آرشیو” شده دانست. با کشف دیانای و پروتئینهای همگون (یا اسیدهای نوکلئیک هم کد) توالی اسید آمینهها (یا پایه دیانای) زیربنای مولکولی برای گذر از یک گونه به گونه دیگر تعریف شد و تفاوت میان این مولکولها روشی برای مطالعه تفاوتها شده است. این چنین علم فیلوژنی یا تبارشناسی نضج گرفت.
ویروسی به نام کرونا، از تبار ویروسهای کوید یا سارس، در دسامبر ۲۰۱۹ در ووهان چین متولد شد. اما این خطه برایش ناآشنا نبود. زیرا اولین نسل ویروس کرونایی هم در نوامبر ۲۰۰۲ در چین ظهور کرد و با شیوع سریع سندرم شدید حاد تنفسی کرونایی باعث اضطرابی جهانی شد و تا ژوئیه ۲۰۰۳ ، منجر به بیش از ۸۰۰۰ مورد ابتلا و ۸۰۰ مرگ در ۲۶ کشور جهان گردید. در سال ۲۰۱۲ اپیدمی جدیدی به نام مرس از عربستان شروع و تا شمال افریقا شایع گردید. نقش خفاش در تمامی این بیماریها و شتر در انتقال ویروس سارس در سال ۲۰۱۲ بسیار پررنگ است.
در دسامبر سال ۲۰۱۹، یک بار دیگر ویروسی مشابه پس از تولد در استان ووهان در چین توانست به سرعت پهنه حیات اجتماعی خود را به کشورهایی چون کره جنوبی، ایران، ایتالیا، فرانسه و سایر نقاط گسترش دهد.
این ویروس نیز در خفاش یافت شده و نقش نوعی از سگهای وحشی در تکامل آن گزارش شده است. بنابراین خفاش به عنوان منبع اصلی این ویروسها و حیوانات دیگر و انسان به عنوان زمینه رشد یا انتقال تشخیص داده شدهاند. ویروس برای سرایت به انسان نیاز به گذر از پستاندار دیگری (شتر، خوک و سگهای وحشی) دارد. برای درک بهتر جایگاه این ویروس جدید در طبیعت امروز، از روش داروین و مطالعه گونهای شروع کرده و به عنصر فردی و تبار ژنی آن میرسیم.
گونهشناسی سنتی:
این نوع بیماریهای تنفسی (سارس سال ۲۰۰۲، مرس در ۲۰۱۲ و کرونا در ۲۰۲۰) از نظر پویایی شباهتهای ظاهری زیادی با هم دارند. اگرچه برای هرسه ویروس انتقال ویروس از طریق مدفوع نیز گزارش شده است اما تصور میشود مسیر اصلی انتقال آنها قطرات تنفسی باشد. ویروس پس از ورود در مجاری تنفسی، در قسمت تحتانی ریه شخص مبتلا به دنبال آنزیمی به نام ایسیای۲ [۴] میگردد. آین آنزیم نقش تنظیمکننده آنژیو تانسین را در بدن دارد. آنژیو تانسین خود تنظیمکننده فشار خون است. ظاهراً این پروتینِ میزبان، نقش گیرنده (درب ورودی درون سلولی) ویروس را نسبت به سایر سلولهای تنفسی بازی میکند.
با وجود اینکه ویروس کوید۱۹ از نظر ژنی با دو ویروس دیگر نزدیکی دارد اما تفاوت تعامل آنها با طبیعت بسیار شگفتانگیز است. مثلا در سال ۲۰۰۳، ویروس سارس پس از اینکه ۸۰۰۰ نفر را مبتلا و حدود ۸۰۰ نفر را در طی ۸ ماه در ۲۶ کشور جهان به هلاکت رساند، بالاخره مهار شد. قرنطینه و مراقبت ویژه در هنگام وخامت تنفسی از مهمترین عوامل مهارآن ویروس بودند. برعکس، ویروس جدید تا روز ۲۸ فوریه ۲۰۲۰، یعنی حدود دو ماه پس از تولدش، بیش از ۸۲۰۰۰ نفر را مبتلا و ۲۸۰۰ نفر را در چین به هلاکت رسانده و ۳۶۰۰ نفر را در ۴۶ کشور دیگر جهان مبتلا کرده است.
حال سوال این است که با وجود تجربه کشورهایی چون چین که هم از امکانات بالا و هم تجربه قبلی ویروس سارس برخوردار است و با اینکه ظرف دو هفته ویروس جدید شناسایی شده است و بلافاصله امکانات تشخیصی در سطح کلان فراهم میشود (در رابطه با سارس بزرگ این روند چند ماه بطول انجامید) چرا طی دو ماه تعداد زیادی انسان درنقاط مختلف جهان مبتلا به این ویروس شدند؟ این مشاهده زمینهساز شایعاتی مبنی بر احتمال حمله مهندسیشده انسان علیه انسان گردید.
چند توضیح پاسخ به این سئوال را ساده میسازد.
اول. استان ووهان مرکز وسیع توسعه یافتهای با ازدحام شدید جمعیت و تماسهای فراوان میان انسانهاست. به عنوان نمونه، میزان رفتوآمد به این استان ظرف ده سال اخیر دو برابر شده است. چند روز قبل از بروز ویروس، تجمعات چند صد هزار نفری به مناسبت عیدسال نو چینی برپا بوده و سفر بیش از پنج میلیون شهروند از این استان به نقاط دیگر زمینه شیوع سریعتر بیماری را در منطقه (نسبت به شیوع سارس ۲۰۰۲) فراهم کرده است.
دوم. نبود تعادل میان سرعت ابتلا با امکانات تختخوابی در مراکز ویژه باعث شد عده زیادی از بیماران خطرناک بستری نشده و به خانه رانده شوند. این ناهنجاری هم تعداد مرگ و میر را بالا برد و هم به گسترش بیماری کمک کرد. ساخت بیمارستانی جدید برای پذیرش بیماران خطرناکتر بدنبال این ناهنجاری صورت گرفت.
سوم. دوران خفتگی ویروس جدید و دوران انتقال آن با ویروس سارس یکسان نیست. بیماران مبتلا به سارس عموما هنگام بروز علائم تنگی نفس، از خود ویروس زنده بیرون میدادند در حالی که کوید۱۹ از همان اوایلِ لانه در آدمها تولید مثل میکند و حتی بدون ایجاد علائم حاد باعث ابتلای انسانهای دیگر میشود. بنابراین دوران واگیری بیماران مبتلا طولانیتر و سرعت سرایت بیشتر است. تعداد مبتلایان این ویروس در عرض دو ماه از تعداد مبتلایان سارس در عرض ۵ ماه بالاتراست. دادههای بدست آمده از کشتیهای تفریحی در ساحل ژاپن و در کالیفرنیا نیز این مشاهده را تایید میکنند. درصد پایین فرمهای بسیار وخیم در مورد ویروس کوید۱۹ این شک را ایجاد میکند که تعداد مبتلایان بسیار بالاتر از میزان حدس زده باشد. تعدادی با نداشتن علائم بالینی ناقل ویروس بوده و هستند. قابل تامل است که ۱۰ در صد ساکنین کشتیها هیچ علامت بالینی حتی بعد از دوران قرنطینه هرگز از خود نشان ندادند در صورتی که تست ویروسی ایشان مثبت بوده است. دادههای آماری کره جنوبی که در سطح وسیع اقدام به تست نمود، این فرضیه را تقویت میکند.
چهارم. با توجه به سه ویژگی بالا (سرعت سرایت، پایین بودن علائم بالینی، پایین بودن در صد موارد مهلک) تعداد مطلق مرگ و میر برآمده از ویروس کوید۱۹ بیشتر از سارس بوده و خواهد بود. این علت دیگر مربوط به تغییرات ذاتی ویروس در طی تغییرات جهشی نسل به نسل نمیباشد. این حاصل عدم همانگی میان سرعت شیوع، دقت و وسواس در پیشگیری و امکانات موجود درمانی ویژه برای موارد مهلک، یعنی مدیریت بهداشت و درمان جوامع بشری است.
خاطره ویروس از تبار خود
در مناطقی از چین، برای تامین گوشت مصرفی نوعی سگ صحرایی به نام سیوت شکار میشود. آمادهسازی نامناسب گوشت این حیوان به عنوان دلیل شیوع ویروس سارس گزارش شده بود[۵]. این ویروس در بدن چند سیوٍت دیده شده است[۶]. در ماه مه سال ۲۰۰۳، در یک بازار حیوانات زنده در گوانگدونگ چین، شواهد مربوط به انتقال این ویروس به حیوانات دیگر از جمله به سگ راکون و نیز انسانهایی که در همان بازار کار میکردند به دست آمد. این شواهد عموما مربوط به ترخیص ژنی ویروس است. مطالعه تبارشناسی ژنی این ویروس نشان میدهدکه انسان این ویروس را ابتدا از خفاش گرفته است و سپس به موجودات دیگری چون خوک و سگ وحشی از نوع هیمالایایی منتقل کرده، و دوباره از حیوانات گوشتخوار به انسان منتقل شده است و همچنان[۷] از موجود زندهای به موجود زنده دیگر منتقل میشود.
همسانی و تفاوتهای ساختاری میان ویروس سارس و کوید۱۹، حکایت از درجه بالای شباهت (۸۶ در صد) دو ویروس دارد. اما نزدیکی ساختار فقراتی ویروس کرونا با ویروس ترخیص شده از خفاش بالاتر از نزدیکی این بخش از ویروس کوید۱۹ با ویروس سارس یا مرس است. کدهای هر دو ویروس شباهت بالایی با ویروسهای یافت شده در خفاش دارند. اما نزدیکی ویروس کوید۱۹ با ویروس خفاشی بالاتر است. بنابراین، تصور میشود که بازارهای حیوانات زنده در مجاورت بازار فروش چندین گونه از حیوانات وحشی و خانگی، و هر دو در مجاورت ازدحامی از جمعیت انسانی، زمینه مناسب خلق ویروس جدید را فراهم کرده است. این ویروس برای بقای خود با استفاده از دو اصل جهش ژنی (ایجاد تنوع و چند گونگی در آرشیو نیاکانی) و تعامل (پلاستیسیته)، مسیر بکری برای تداوم خود یافته است.
دانشمندان الگوی ژنتیکی پروتئین سنبله، آرماتورها و قسمت بیرونی ویروس را شناسایی کردند. ویروس از این آرماتورها برای اتصال به دیوارههای خارجی سلولهای انسانی، گرفتن اطلاع از آنها و نفوذ به درون آنها، استفاده میکند. به طور خاص اتصال ویروس کوید از ویژگی مهم پروتئینی برخوردار است. وجود دو پروتئین در سنبله، ویروس آنرا منحصر به فرد میکند. پس از چسبندگی، مکان گیرنده ویروس (آر بی دی) در پناه پروتئینهای قلاب به سلولهای میزبان چسبیده تا شکافی در غشای سلول میزبان واردکرده و چون قوطی باز شده امکان ورود مولکولهای ویروسی به درون سلولهای میزبان را فراهم کند.
شواهدی برتکامل طبیعی و نه مهندسی عمدی
دانشمندان دریافتند که بخشی از پروتئین سنبله تکامل یافته تا بطور مؤثرتری به مولکولهای غشایی سلولهای انسانی اتصال یابد. این گیرنده غشایی همان پروتینی است (ای سی۲) که در تنظیم فشار خون نقش دارد. در حقیقت پروتئین سنبله در اتصال سلولهای انسانی چنان مؤثر است که دانشمندان نتیجه گرفتند که این نمیتواند حاصل امری جز انتخاب طبیعی و تعاملی ویروس خفاشی و بستر جدیدش، یعنی بافت ششی انسان، باشد. (مراجعه با تصاویر پایان مقاله)
اصولا این شاهدی بر تکامل طبیعی کدهای ژنتیکی ستون فقرات ویروس سارس۲ است. اگر شخصی به دنبال مهندسی ویروس کرونای جدید برای ایجاد یک بیماری لاعلاج میبود، میتوانست با استفاده از تغییرات از قبل شدیدار شده در کدهای ستوان فقرات ویروسی که سابفه ایجاد بیماری دارد (مانند سارس یا مرس) استفاده کرده و وجوه ویژه نوینی به آن اضافه کند. به عبارت دیگر ستون فقرات ویروس شناخته شدهای را ابتدای ساخت خود قرار داده و با ایجاد تغییرات جنبی، ویروس جدید را خطرناکتر کند. اما با مشاهده نزدیکی ستون فقرات ویروس جدید با ویروسهای خفاشی، که اصولا خوش خیم هستند، و دوری تباری کد ژنتیک ستون فقرات از ویروس سارس، فرضیه انتقال طبیعی از خفاشها و پنگولینها به انسان را قویتر میکند. این دو ویژهگی ویروس یعنی جهش در بخشی از پروتئین سنبله و تداوم ستون فقرات تباری آن، استفاده از دستکاری آزمایشگاهی عمدی را بیاعتبار کرده و شایعاتی که در مورد منشاء لابراتوری ویروس در گردش است را بیاساس مینماید.
دو سناریو در مورد تحول طبیعی متصور است:
در سناریوی اول ویروس خفاشی قبل ار سرایت به انسان دستخوش این دو تغییر اساسی شده و در شرایطی استثنائی از طریق حیوان واسطی به انسان سرایت میکند. در سناریوی دوم، ویروس خفاشی پس از سرایت به انسان دستخوش تغییرات کشنده میشود. شباهتهایی میان سنبله و پروتین شکافانداز این ویروس و ویروسهایی که از برخی سگهای وحشی در افریقا و آسیا در دست است این فرضیه تحول داروینی مرحله به مرحله را قویتر میکند. می توان چنین تصور کرد که ویروس کرونا پس از ورود به بدن اولین انسانها و با اقتباس از دادههای ویروسهای گریپ که استعداد بالایی در پرش از انسانی به انسان دیگر دارند به این سلاح جدید مجهز شده است. با فرضیه اول، احتمال افزایش شیوع بیماریهای مشابه در آینده بیشتر میشود. زیرا ویروسهای شبهکرونای خطرناک در حیواناتی در مجاورت انسان در گردش بوده و ممکن است یک بار دیگر به سمت انسان پرش کنند. در فرضیه دوم احتمال اینکه ویروسی خوش خیم وارد بدن انسان شده و سپس دستخوش جهش شده باشد احتمال بروز بیماری ویروسی کاملا مشابه را ضعیف میکند. زیرا طبق اصل تحول پلاستیک موجود، انسان و ویروسها در گریز از این نداده است احتمال به تعامل میرسند.
تعامل و تکامل
آیا میتوان ویروس جدید را حاصل تغییر تصادفی ندانست و نظریه انتخاب اصلح عامدانه را پذیرفت؟ بیشک چند سالی است محققینی که بر روی ساختار ژنی این ویروسها مطالعه کردهاند علائم این مصیبت جهانی را بررسی کردهاند. مطالعهای که در سال ۲۰۱۷ منتشر شد[۸]، یکی از این اعلام خطرها را بدنبال داشت. محققین پس از ۵ سال مراقبت از خفاشهایی که در غاری در استان ووهان چین زندگی میکردند، نشان دادند که تمام چاشنیهای یک پاندمی وسیع فراهم است. از طرفی تلفیقهای متوالی میان ویروسهای خفاش روندی ممتد داشته است، یعنی نسلهای پی در پی ویروسها کلیه ملزومات ساختاری زندگی و تطبیق با محیط زیست در پستانداران را حفظ کردهاند. و از طرف دیگر حداقل یکی از پروتئینهای غشای ویروسی چنان خود را به سطح کمال رسانده که تغییرات ژنتیکی آن گیرایی و اتصال پروتین غشایی ویروس به پروتینای سی۲ آنژیوتانسین انسان روندی صعودی داشته.
شرایط احتمالی ناهنجار زیست ویروسها از خفاش به انسان دلیلی بر تغییر مواد ژنتیکی برای تعامل زیست است. باتوجه به مجاورت این غار در فاصله یک کیلومتری منطقه مسکونی مردم شهری، یعنی تماس آسان با انسان، امکان خطر انتقال تصادفی به انسان و ایجاد جهش ژنی برای زیست در ریه انسان بیشتر قوت میگیرد.
حال که نزدیکی ژنی ویروس کرونا با ویروسهای خفاشی بیشتر از نزدیکی این ویروس با ویروسهای سارس یا مرس نشان داده شد، ترس محققین از مجاورت غار پر از خفاش با منطقه مسکونی و خطر بروز آسیب کشنده جهانی از طریق دستگاه تنفسی را موجه کرد. سادهتر بگوییم که ویروس کرونا به تغییرات تکاملی واگرا نزدیکتر است تا تحول همگرا. در واقع اگر انسان در این ساختمان ویروسی جدید نقشی داشته باشد، باید آن را در بیتوجهی به اقلیم و تخریب آن جستجو کرد تا یک سناریوی امنیتی. این مشاهدات را باید مستقل از نیاز یا اراده ساختار امنیتی کشوری که در تلاش برای بدست آوردن سلاح بیولوژی دانست. دستکاری باکتریها و ویروسها برای استفادههای درمانی در بسیار از لابراتورهای جهان رایج است. اما تکنولوژی در دسترس امکان ساخت موجود زندهای که با اراده موجود زنده دیگری وارد عمل شود را نداده.
رابطه پویا میان ویروس و میزبان، نمونهای از رابطه پلاستیک
در ادرار و مدفوع حیوانات بیش از لاشههای ژنی انسان لاشههای ژنی قارچها، باکتریها و مقدار بسیار کمی ویروس یافت میشود[۹]. لاشههای ژنی ۴۳ خانواده ویروسی مختلف در مدفوع و ۲۲ خانواده مختلف در ادرار خفاشهای سنگاپور یافت شدهاند. ویروس کرونا در حدود ۱۵ در صد کل ژنهای ویروسی موحود در ادرار خفاشها تخمین زده شده است.
مطالعات متعددی نشان میدهند که ویژگی ژنتیک ویروسهای سارس و مرس با توسل به جهش ژنی به تعاملی رسیده که همزمان با ویژگیهای میزبان مجموعهای را فراهم میسازند که درآن شدت عکسالعمل تا سطح مرگ پیش میرود در صورتی که همین ویروسها در خفاش هیج نوع تنشی ایجاد نکرده و با زمینه به تعامل صلح آمیز میرسند[۱۰].
نتیجه
دنیای ویروسها همانند دنیای همه موجودات زنده دستخوش تغییرات است. محیط زیست میدان بروز این تغییرات بوده و انسان از این مسیر در تغییرات موجودات تک سلولی بیتاثیر نیست. این ارتباطات طبق قوانین پلاستیسیته عمل میکنند. با توجه به همین قوانین، دادههای علمی نوین نشان میدهند که تغییرات مشاهده شده ناشی از نابسامانی است که انسان به محیط زیست خود و سایر موجودات تحمیل کرده است.
پاریس - کرتی در فرانسه، ۲ فروردین سال ۱۳۹۹
***
شکلهای زیرو توضیحات مندرج شده به درک بیشتر مقاله کمک خواهد کرد
ساختمان ژنی ویروس کرونا در انسان و مقایسه آن با ویروس سارس و مرٍس و دیگر ویروسهای ترخیص شده از خفاش دو ماه پیش منتشر گردید. این مقایسه که تمام کدهای آرشیو نیاکانی را در بر میگیرد امکان ترسیم تباری ویروس را فراهم میسازد. در نمودار اولیه رده کدها دسته بندی شده اول از چپ به راست (رنگ زرد) سری کدهای کلیدی خوانش و ساختاری هستند که ازکدهای پروتینی مجزا میباشند. این سری با وجود تفاوت محسوس با نسل اول همین بخش از کدهای ویروس خفاشی (D) به نسل دوم همین ویروس در خفاش (c) نزدیکی پیدا کرده و تا حدود زیادی با همین سری از کد ویروسهای سارس و مرس نزدیکی دارد. کدهای خوانش پروتینی در قسمت آبی به سنبله، قرمز به غشا، بنفش به هسته و ارغوانی به پروتئینهای جنبی مربوط میباشند و در رده A نمونه ویروس انسانی کرونای ۱۹، در رده B ویروس انسانی سارس ، در رده c ویروس انسانی مرس در انسان و خفاش و در رده D ویروس اولیه خفاش نشان داده شده اند[۱۱].
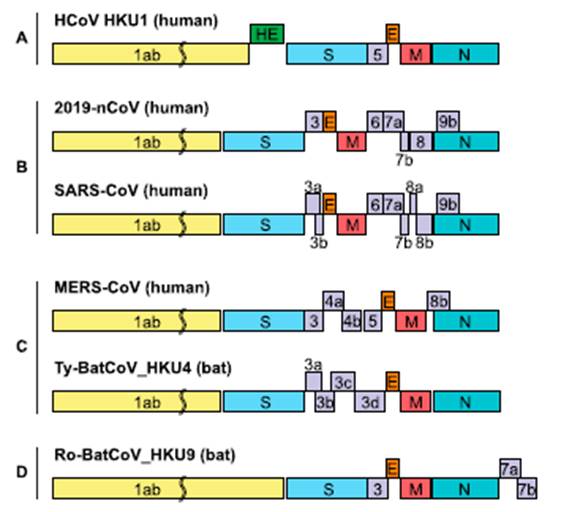
پس از ترخیص و ترجمه کدهای ژنتیکی به کدهای پروتینی نمودار پایین تشابه و تفاوتهای همین ویروسها را نشان میدهد.
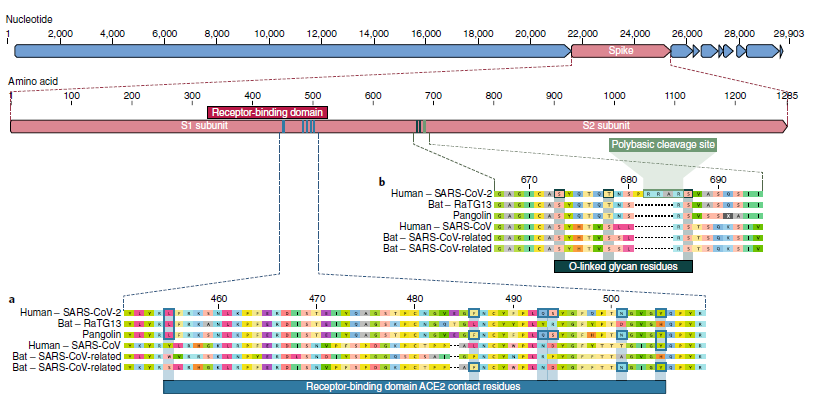
پس از مقایسه و محاسبه فاصله زمانی تحولاتی بر طبق روشهای محاسباتی تایید شده نمودار پایین بدست آمده که حکایت از وجود اشتراک تباری میان این ویروسها دارد.
مقایسه کدهای ژنی میان ویروس کرونای انسانی و ویروسهای ترخیص شده از خفاش نشان از نزدیکی ۹۵ الی ۹۹ درصدی در بسیاری ازرستهها دارد.مهمترین تفاوت کدی میان این ویروسهارا درناحیهای از پروتین ویروسی میتوان یافت که نقش گیرندگی یا چسبندگی برروی غشای میزبان ویروس است.
بنابراین شجرنامه(نسب نامه) ویروس این گونه ترسیم میشود (ویروس امروز به رنگ قرمز مشخص شده است).
مطالعه کدهای ژنی ویروسها نشان میدهد که ویروس کورانای ۱۹ بزرگترین تفاوت خود را با هم تبارانش در پروتئین لازمه ورود در سلول انسان متمرکز کرده است. این پروتئین از لحاظ ساختاری و موضع ساختمانی در میکروسکوپهای الکترونی (با قابلیت دید و تعریف بسیار ریز) رویت و به این صورت عکسبرداری شده است.
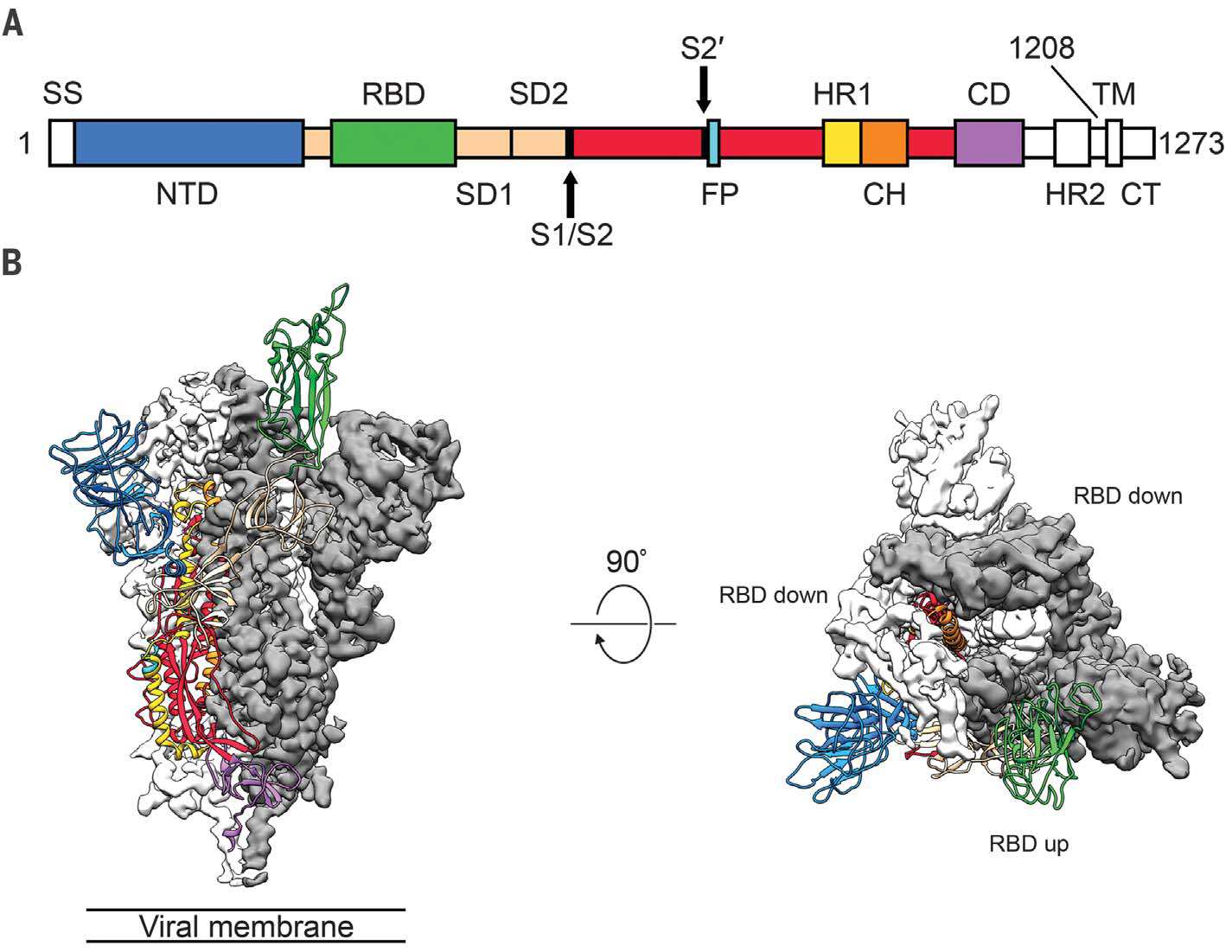
پروتئین اس نوعی از پروتئینهای غشای ویروسی است که نسبت به پروتئینهای ویروسهای تباری درکدهای خود تا حدی تغییرات انجام داده که تلفیق آن را در پروتینهای غشای سلولی انسان آسان نماید و بدین ترتیب سریعتر از پیش کسوتهای خود وارد بدن انسان میشود[۱۲].
—————————————————-
[1]چارلز رابرت داروین (Charles Robert Darwin)، متولد ۱۲ فوریه۱۸۰۹ انگلستان – درگذشته ۱۹ آوریل۱۸۸۲،
[2] Phenotype
[3]DNA :DeoxyNucleotid Acid (In French, ADN AcidedéoxyNuclique)
[4] ACE2 (AngitensinCoverting Enzyme 2)
[5] World Chelonian Trust (2002). Palm Civets (Pagumalarvata) and SARS World Chelonian Trust, California
[6]Guan, Y., Zheng, B.J., He, Y.Q., Liu, X.L., Zhuang, Z.X., Cheung, C.L., Luo, S.W., Li, P.H., Zhang, L.J., Guan, Y.J., Butt, K.M., Wong, K.L., Chan, K.W., Lim, W., Shortridge, K.F., Yuen, K.Y., Peiris, J.S., Poon, L.L. (2003). Isolation and characterization of viruses related to the SARS coronavirus from animals in southern China. Science 302 (5643): 276–278.
[7] Caldwell, E. (2008). Evolutionary History of SARS supports Bats as virus source Archived 23 June 2011 at the Wayback Machine Research News, Ohio State University.
[8]Hu B, Zeng L-P, Yang X-L, Ge X-Y, ZhangW, Li B, et al. (2017) Discovery of a rich gene poolof bat SARS-related coronaviruses provides newinsights into the origin of SARS coronavirus. PLoSPathog 13(11): e1006698. https://doi.org/10.1371/journal.ppat.1006698
[9]Mendenhall IH, et al Diversity and evolution of vieral pathogen community in cave nectar Bats. Viruses 2019; 11(3): 250
[10]Widagdo W et al. Host determinants of MERS-CoV transmission and pathogenesis. Viruses 2019; 11(3): pili: E280
[11]اقتباس از
Jasper Fuk-Woo Chan, et al. Genomiccharacterization of the 2019 novelhuman-pathogenic coronavirus isolatedfrom a patient withatypicalpneumoniaaftervisiting.Emerging Microbes & Infections. Published online: 28 Jan 2020; 9:1, 221-236, DOI: 10.1080/22221751.2020.1719902
[12] Figure. Structure of 2019-nCoV S in the prefusion conformation. (A) Schematic of 2019-nCoV Sprimary structure colored by domain. Domains that were excluded from the ectodomain expressionconstruct or could not be visualized in the final map are colored white. SS, signal sequence;S2′, S2′ protease cleavage site; FP, fusion peptide; HR1, heptad repeat 1; CH, central helix;CD, connector domain; HR2, heptad repeat 2; TM, transmembrane domain; CT, cytoplasmic tail.Arrows denote protease cleavage sites. (B) Side and top views of the prefusion structure of the2019-nCoV S protein with a single RBD in the up conformation. The two RBD down protomers are shownas cryo-EM density in either white or gray and the RBD up protomer is shown in ribbons coloredcorresponding to the schematic in (A).